الجدول الدوري غير معروف الجزء 3
محتوى
الحلقة الأخيرة من المقال حول الجدول الدوري ، باستثناء الحلقة المدرسية (يتوافق مع عنوان السلسلة بأكملها). اليوم حول المجموعات التي يتم تجاهلها عادةً من الجدول الدوري ، والعناصر الاصطناعية التي لا نعرف عنها شيئًا عمليًا ، وحول ما ينتظرنا في الفترة الثامنة.
يتم التعامل مع صفين ، يوضعان عادةً تحت السبورة ، بازدراء في المدرسة - سيذكر المعلم وجودهما فقط وينتقل إلى عناصر أخرى "أكثر أهمية". غير مناسب تمامًا للوظيفة التي يؤدونها في العالم الحديث. فن i بلوتو () تشكل أساس الطاقة النووية: مصدر موثوق في أي ظروف مناخية (على عكس الطاقة غير التقليدية) ، وعند استخدامها بشكل صحيح ، فهي آمنة وصديقة للبيئة. تعد اللانثانيدات حاليًا مادة خام إستراتيجية مطلوبة في العديد من التقنيات المتقدمة ، على سبيل المثال ، لن توجد الإلكترونيات الحديثة بدون اللانثانيدات. ولكن حتى الآن ، من الصعب كسر كلا المجموعتين بسبب قانون الدورية.
المشكلة رقم 1: اللانثانيدات
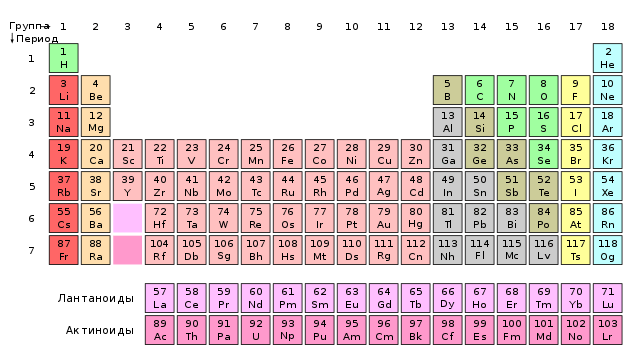
مندليف لم يكن يعرف سوى عدد قليل من اللانثانيدات وتمكن من تضمينها في الجدول دون صعوبة كبيرة (1). لكن في السنوات اللاحقة ، تحدت اكتشافات مثل هذه المعادن قانون الدورية ذاته. يتطلب عناصر متتالية أن تقع في مجموعات متجاورة ولها تكافؤات مختلفة. في هذه الأثناء ، كانت اللانثانيدات ذات الكتل الذرية المختلفة قليلاً (مما يعني أنه يتعين عليها الوقوف واحدة تلو الأخرى في صف مستمر) دائمًا ما يكون لها تكافؤ يساوي III (بعضها أيضًا II أو IV) ، أي أنها كانت في نفس المجموعة. تم طرح العديد من النظريات حول اللانثانيدات، على سبيل المثال ، تم اعتبارهم جميعًا نفس العنصر في إصدارات مختلفة. تم حل المشكلة عن طريق وضع اللانثانيدات في "صندوق" واحد من النظام ، لكن ميكانيكا الكم فقط في العشرينات والثلاثينيات من القرن الماضي أوضحت موقعها في الجدول الدوري.
1. السيريوم ، اللانثانيد الأكثر شيوعًا. جميع اللانثانيدات الأخرى متشابهة وتبدو مثل الألومنيوم ()
لا تزال مشكلة اللانثانيدات قائمة حتى اليوم. في الواقع ، ليس معروفًا بأي عنصر يبدأون وينتهون. وفقًا لمعظم الكتب المدرسية ، فإن اللانثانم ، على الرغم من أنه أعطى الاسم للعائلة بأكملها ، لا ينتمي إليها - إنه كذلك فضيحة المجموعة 3اللانثانيدات هي معادن من السيريوم إلى اللوتيتيوم. ومع ذلك ، فإن الآراء المتعارضة تشير إلى أن آخر فرد في الأسرة يقوم بالمسح بشكل أفضل. للصلاة. تتطابق خواصه الفيزيائية والطبيعة الكيميائية للمركبات الناتجة بشكل أفضل مع عناصر المجموعة 3 الأخرى (وبالتالي ، فإن اللانثانيدات عبارة عن معادن من اللانثانوم إلى الإيتربيوم). تستمر المناقشات بين الكيميائيين حتى يومنا هذا ، ويقدم مؤلفو الكتب موقع هذه العناصر بطرق مختلفة (2).
2. أطول شكل من أشكال الجدول الدوري. تبدأ اللانثانيدات والأكتينيدات مباشرة بعد المجموعة 2 ، وتشمل اللانثانيدات والأكتينيدات اللوتيتيوم واللورينس.
المشكلة رقم 2: الأكتينيدات
الأكتينيدات، أي ، العناصر من الأكتينيوم إلى لورانس ، تشكل مجموعة مماثلة اللانثانيدات ، وضعت في الفترة المقبلة. كانت مشكلة الأكتينيدات ولا تزال كما هي مع اللانثانيدات. عرف مندليف اثنين فقط من الأكتينيدات وأدرجهما دون صعوبة في الجدول (3). تور مع أقوى تكافؤ ، ذهبت المجموعة الرابعة إلى مجموعة التيتانيوم والزركونيوم ، والمجموعة السادسة بالقيمة اليورانيوم وجدت في شركة الكروم والموليبدينوم والتنغستن.
صدمت الاكتشافات في مطلع القرنين XNUMXth و XNUMX النظام: ظهر هناك دزينة أو نحو ذلك من العناصر المشعة. كان لبعضهم نفس الكتلة ، لكن لديهم خصائص مختلفة ، بينما كان للبعض الآخر نفس الخصائص - كتل مختلفة. تناقضت هذه الحقيقة مع المعرفة السابقة ، لكن اكتشاف النظائر أوضح بعض المشكلات. تبين أن معظم العناصر عبارة عن خليط من الذرات ذات الكتل المختلفة (ولكن ، بالطبع ، مع نفس عدد البروتونات في النواة). بالعودة إلى الأكتينيدات ، ظهر اثنان منهم في بداية القرن الماضي. تبين على الفور أن الأكتينيوم يشبه اللانثانم (تم العثور على نشاطه الإشعاعي في رواسب اللانثانيدات المترسبة من المحاليل المحتوية على الأكتينيوم) ، وانخفض البروتكتينيوم في المجموعة مع الفاناديوم والنيوبيوم والتنتالوم كعنصر قيم V. حتى الأربعينيات ، كانت الأكتينيدات الأربعة الأولى تقع بهدوء في مجموعات من 40 إلى 3.
3. الأكتينيدات الأكثر شيوعًا: على اليسار يوجد الثوريوم ، مغطى بطبقة من ثاني أكسيد ، وعلى اليمين يوجد اليورانيوم ()
نشأت المشكلة أثناء تنفيذ مشروع مانهاتن. كان الفيزيائيون والكيميائيون على يقين من أنهم قد أنتجوا عناصر أثقل من اليورانيومومع ذلك ، لم يتمكنوا من اكتشاف وجودهم بالوسائل الكيميائية. على سبيل المثال: العنصر 93 الموجود بجانب اليورانيوم لم يتصرف كعضو في المجموعة 7. لقد كان فقط اقتراح غلين سيبورج ، المكتشف اللاحق للعديد من عناصر ما وراء اليورانيوم ، أن العناصر التي تبدأ من صفوف الأكتينيوم تشبه اللانثانيدات قد حلت المشكلة (4 ). إن استخدام الطرق المطورة لفصل اللانثانيدات ، وخاصة اللوني ، جعل من الممكن في السنوات اللاحقة تحديد العناصر الاصطناعية. يتضح كمال التكنولوجيا ومهارة المجربين من حقيقة أن وجود بعض العناصر الجديدة تم اكتشافه مع اثنتي عشرة ذرات فقط! (خمسة).
لكن لا تصدق أن الثوريوم أو اليورانيوم غيروا خصائصهم فجأة وأصبحوا معادن ثلاثية التكافؤ تشبه اللانثانيد. لا يزال لديهم قواسم مشتركة مع التيتانيدات والكروم أكثر من الأكتينيدات الأخرى. وبالمثل مع البروتكتينات وحتى بعض علماء ما بعد اليورانيوم. لا يمكننا التحدث إلا عن تشابه معين في النصف الثاني من السلسلة. ومع ذلك ، لا يمكن القول بأن اللانثانيدات والأكتينيدات هي عائلات مرتبطة (كما لو أن وضعها في الجدول الدوري يوحي بموقعها).
4. يعطي جلين سيبورج (1912-99) الرمز الخاص بالعنصر المسمى باسمه.
5. مسقط رأس العديد من علماء ما بعد اليورانيوم هو سيكلوترون في مختبر لورانس بيركلي الوطني (أغسطس 1939)
لا توجد بيانات تجريبية
ترتبط المعرفة غير الدقيقة بخصائص أثقل ما وراء اليورانيدات بكمية غير كافية من المواد للبحث. العنصر الأخير الذي يتم إنتاجه بكمية ملحوظة من الملليغرام هو أينشتاين ، المصنف 99 على الطاولة. بالطبع ، يتم إجراء التجارب أيضًا مع ترانسورانيدات أخرى ، ولكن في حالتهم ، على سبيل المثال ، تتم دراسة الإشعاع المميز الناتج في الراسب ، ولا يتم ملاحظة تكوين بلورات المركبات.
الخصائص الفيزيائية والكيميائية لا يمكن قياسها ببساطة ، ولكن تقديرها فقط من الملاحظات غير المباشرة. تحدث مشكلة مماثلة مع عنصرين أخف وزناً: أستاتو (رقم 85) ط الفرنسية (رقم 87). بسبب قصر عمرها ، لم يتم الحصول على الكميات المرئية بعد ، ويجب على النظرية سد الفجوات في الملاحظات والقياسات. من ناحية أخرى ، يبلغ الإنتاج السنوي للبلوتونيوم ، الموجود بكميات ضئيلة في قشرة الأرض ، عدة أطنان وهو مفهوم بشكل أفضل من العديد من العناصر الثابتة الأخف وزناً.
مشكلة أكبر مع أثقل العناصر مع فترة 7 بعد الأكتينيدات. في حالتهم ، يتعين على المرء أن يعمل بذرات منفصلة حرفياً ، ويتم حساب عمرها في أجزاء من الثانية. لم يعد من الممكن تحديد النشاط الإشعاعي الموجود في راسب مركب مرتبط بعنصر ما ، ولكن فقط للتحقق من بعض الخصائص الفيزيائية (مثل معدل الترسيب على سطح معين) وبالتالي استخلاص استنتاجات حول التشابه الكيميائي. بالطبع تساعد النظرية ، أو بالأحرى الحسابات القائمة على ميكانيكا الكم. ومع ذلك ، فإن النتائج ليست موثوقة بنسبة 100 ٪ ، على سبيل المثال ، وفقًا لتوزيع معين للإلكترونات على الأصداف ، لا يزال وصف الخصائص الكيميائية بعيدًا. كلما ابتعدنا عن بيانات المراقبة المباشرة ، كلما أصبح الاستنتاج غير الموثوق به أكثر استنتاجًا لـ "طريقة منديليف" (أي استنادًا إلى خصائص العناصر المعروفة).
يحاول الكيميائيون والفيزيائيون التنبؤ بخصائص حتى أثقل العناصر التي لم يتم الحصول عليها في الفترة القادمة. من المحتمل أن يكون للعنصرين 119 و 120 سمات لا تختلف كثيرًا عن تلك الموجودة فوق الفرانسيوم والراديوم (في المجموعتين 1 و 2 ، يكون التغيير في الخصائص الفيزيائية والكيميائية أمرًا طبيعيًا تمامًا). في الفترة الثامنة ، مثل اللانثانيدات والأكتينيدات ، سيكون هناك ما يصل إلى 8 خاصية متشابهة جدًا لعناصر g-block التي لم يتعامل معها العلماء بعد.
تشير الحسابات إلى وجود عناصر ذات تكافؤ يصل إلى 12 خلال هذه الفترة. من المحتمل أن يكون العنصر 164 في النظام ، وبالنسبة للعناصر الأثقل ستكون الشحنة النووية كبيرة جدًا بحيث تسقط الإلكترونات عليها ، وتتجاوز السرعة المدارية سرعة الضوء. الحسابات التي تم إجراؤها لا تعطي نتائج لا لبس فيها ، فبعضها يغير حدود الجدول الدوري بحوالي عشرة عناصر.
قانون الدورية في سلة المهملات؟
بعد قراءة المقال ، ربما توصلت إلى استنتاج مفاده أن عدد كبير من الاستثناءات من القواعد المعطاة في المدرسة ، يمنحك هذا الحق في الإجابة على السؤال بالإيجاب. لكن لا تعطيه بسرعة كبيرة. قانون الدورية تمت صياغته بطريقة عامة جدًا (تتكرر الخصائص بشكل دوري) ، والتي تعتبر ميزتها وعيوبها. الميزة ، في الواقع ، من خلال تحليل موضع عنصر في جدول مبني على أساس القانون ، يمكن للمرء أن يستخلص استنتاجات حول خصائصه الفيزيائية والكيميائية. عيب ، حيث أن الاستنتاجات غالبًا ما تكون غير دقيقة أو حتى خاطئة.
قانون الدورية يعمل بشكل جيد في المجموعات الرئيسية (1 ، 2 ، 13-18) ، أفضل في الأجزاء العلوية منه في الأجزاء السفلية. المثال المثالي هو الفترة 3: من الصوديوم إلى الأرجون ، تتغير الخصائص الكيميائية التكافؤ بانتظام دون أي مفاجآت. في المجموعات الجانبية (3-12) ، تظهر الانحرافات بوضوح بالفعل ، لكنك قرأت عن مشاكل اللانثانيدات والأكتينيدات أعلاه. بشكل عام ، كلما ابتعد النظام عن بداية النظام ، قل استيفاء قانون الدورية.
حتى في سلة المهملات؟ الكون من العناصر الكيميائية والعلاقات التي ينشئونها هي نظام معقد للغاية لدرجة أنه حتى فكرة مندلييف الرائعة لا يمكنها استيعابها بالكامل. يحتاج القانون بالتأكيد إلى التصحيح والتوضيح. إذا قارنا مندليف مع نيوتن (بما أن كل من قانون الدورية ونظرية الجاذبية نظمتا وفسرا أجزاء كبيرة من العالم من حولنا) ، يمكننا أن نستنتج أن الكيميائيين ما زالوا ينتظرون أينشتاين.
انظر أيضا:

